Les caractérisations, analyses, séparations, purifications des molécules biologiques (peptides, protéines, oligonucléotides) sont indispensables pour identifier ou pour obtenir une molécule la plus pure possible en vue de son utilisation en tant que molécule thérapeutique ou encore pour connaître son rôle dans l’organisme, sa structure et ses interactions.
Il existe un grand nombre de techniques d’analyse ou de purification (Ultrafiltration – Electrophorése-Protéomique- Cristallographie – Chromatographie).
Dans cet article, nous nous intéressons aux techniques chromatographiques : Phase Inverse (RP), Echanges d’ions (IEX), Chromatographie d’exclusion (SEC), Interactions Hydrophobes (HIC), Interactions Hydrophiles (HILIC), Affinité (AFC).
Les différentes techniques analytiques permettent de connaître la séquence peptidique d’une protéine, d’analyser les aggrégats protéiques ou bien de distinguer les isoformes, les variants de charges ou de glycosylation et également de séparer les ADC – Antibody Drug Conjugate.
Ces étapes analytiques sont un préalable indispensable à la connaissance parfaite de la molécule que nous aurons à purifier.
Anticorps
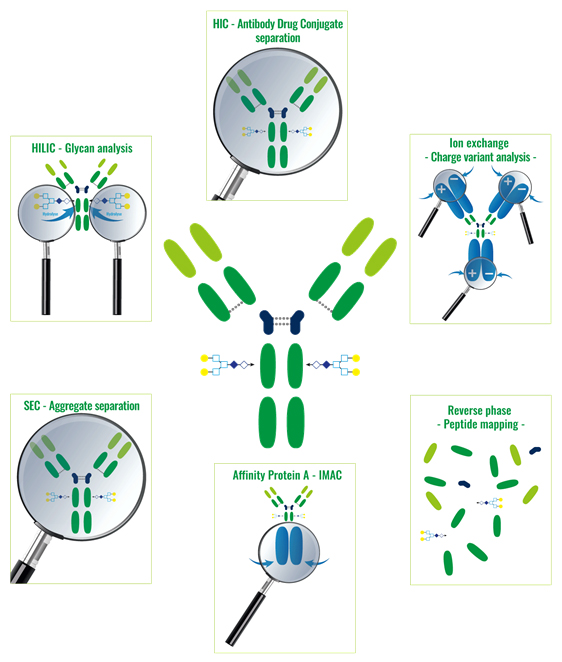
Les différentes techniques chromatographiques le plus souvent employées sont les suivantes :
1. Phase inverse (RP) :
Séparations des molécules en fonction de leur hydrophobicité
2. Echanges d’ions (IEX) :
Séparations des molécules en fonction de leurs charges globales
3. Affinité (AFC) :
Séparations des molécules en fonction de leur affinité avec la protéine A, G ou L ou des ions métalliques (technique IMAC – Immobilized Metal Affinity Chromatography)
4. Chromatographie d’exclusion (SEC):
Séparations des molécules en fonction de leurs tailles
5. Interactions hydrophobes (HIC) :
Séparations des molécules en fonction de leur hydrophobicité
6. Interactions Hydrophiles (HILIC) :
Séparations des molécules en fonction de leur hydrophilicité
Biomolécules
Principe basique de la chromatographie
Dans une colonne, une phase mobile pousse les analytes à travers des billes (de silice, d’agarose, de polyméres) :
C’est le principe de “diffusion”
En fonction des interactions proposées, les analytes sont plus ou moins retenus

1. Phase Inverse – RP
La technique RP – Phase Inverse – sépare les molécules en fonction de leurs caractéristiques d’hydrophobicité.
La RP est très efficace pour les purifications des peptides et les analyses des protéines.
Rarement utilisé pour les purifications des protéines instables dans les solvants organiques (technique destructive).
2. Echanges d’Ions – IEX
La technique IEX – Echanges d’Ions – sépare les molécules en fonction de leur charge globale de surface. Si la molécule d’intérêt est chargée négativement nous parlerons d’échanges d’anions, si la molécule est chargée positivement nous parlerons d’échanges de cations.
3. Affinité – AFC
La technique d’affinité sépare les molécules en fonction de leur ”affinité” avec un support active. Il s’agit d’une séparation sélective d’une biomolécule de ses formes inactives ou dénaturées.
 |
Avantages
Désavantage
|
 |
4. Chromatographie d’exclusion – SEC
La technique SEC sépare les molécules en fonction de leur taille ou de leur encombrement.
L’élution est inversement proportionnelle au radian hydrodynamique des molécules – les grosses molécules sortent en premier.
La technique SEC est utilisée dans les études d’aggrégations et de re-conformations des protéines ainsi que dans le dessalage des solutions protéiques.
5. Interactions Hydrophobes – HIC
La technique HIC sépare les molécules en fonction de leur charge globale de surface.
Cette technique est pH et force ionique dépendante.
La technique HIC est particulièrement bien adaptée aux purifications des ADC – Antibody Drug Conjugate – lesquels sont des complexes moléculaires constitués par un anticorps monoclonal sur lequel sont greffées des molécules chimiques à activités thérapeutiques.
6. Interactions Hydrophiles – HILIC
La technique HILIC sépare les molécules en fonction de leur hydrophilicité.
Cette technique est avant tout dédiée aux analyses des molécules glycosylées (Glycans).
Cette technique, très efficace pour les purifications des variants de glycosylation, est rarement utilisée pour les purifications des protéines instables dans les solvants organiques (technique destructive)
La technique HILIC est l’inverse de la chromatographie en phase inverse.
Le support chromatographique est hydrophile et la sortie des molécules est de la moins polaire à la plus polaire qui est l’ordre inverse de la phase inverse.